2月批准193个医疗器械产品注册 注册医疗器械要准备这些材料
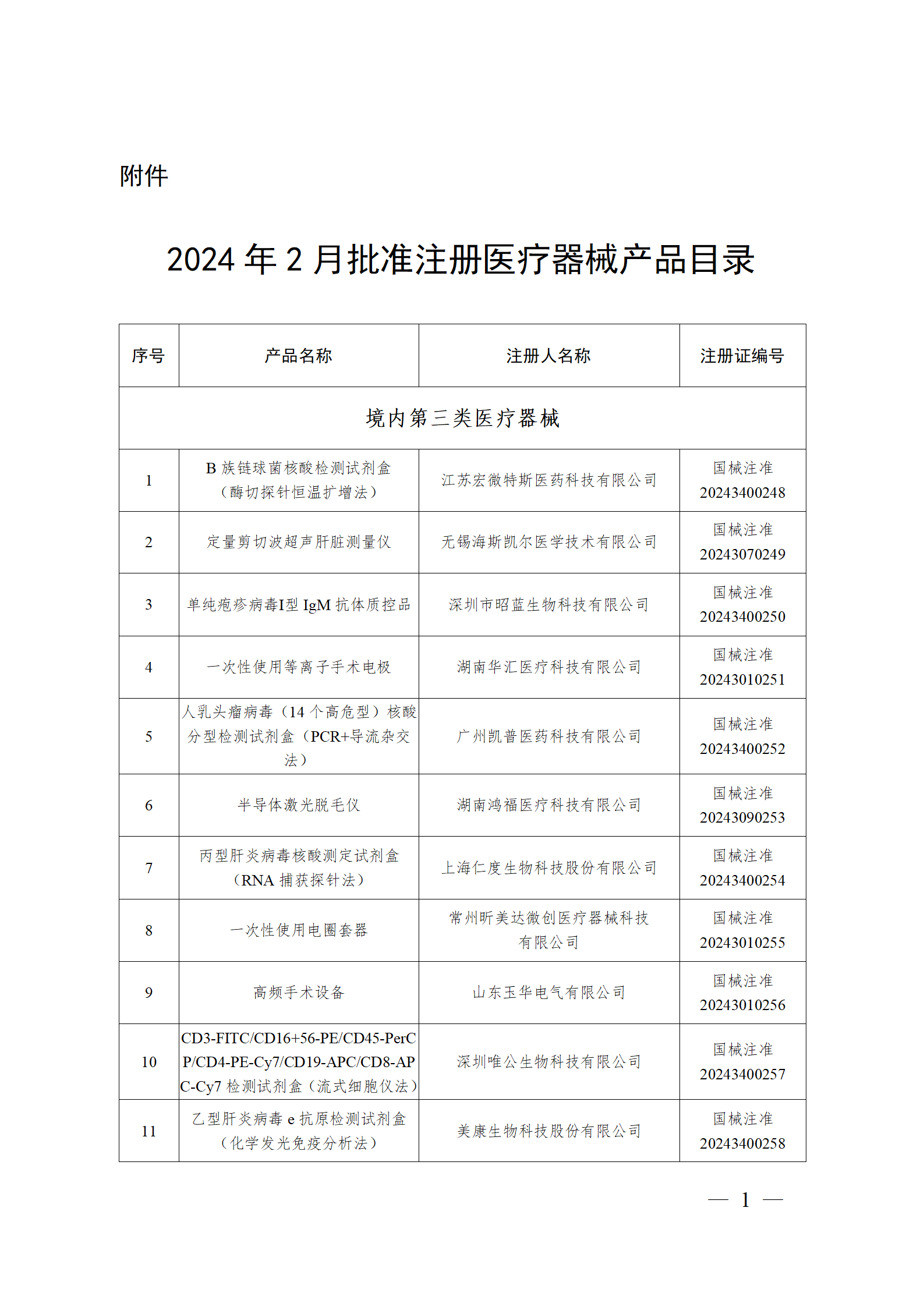
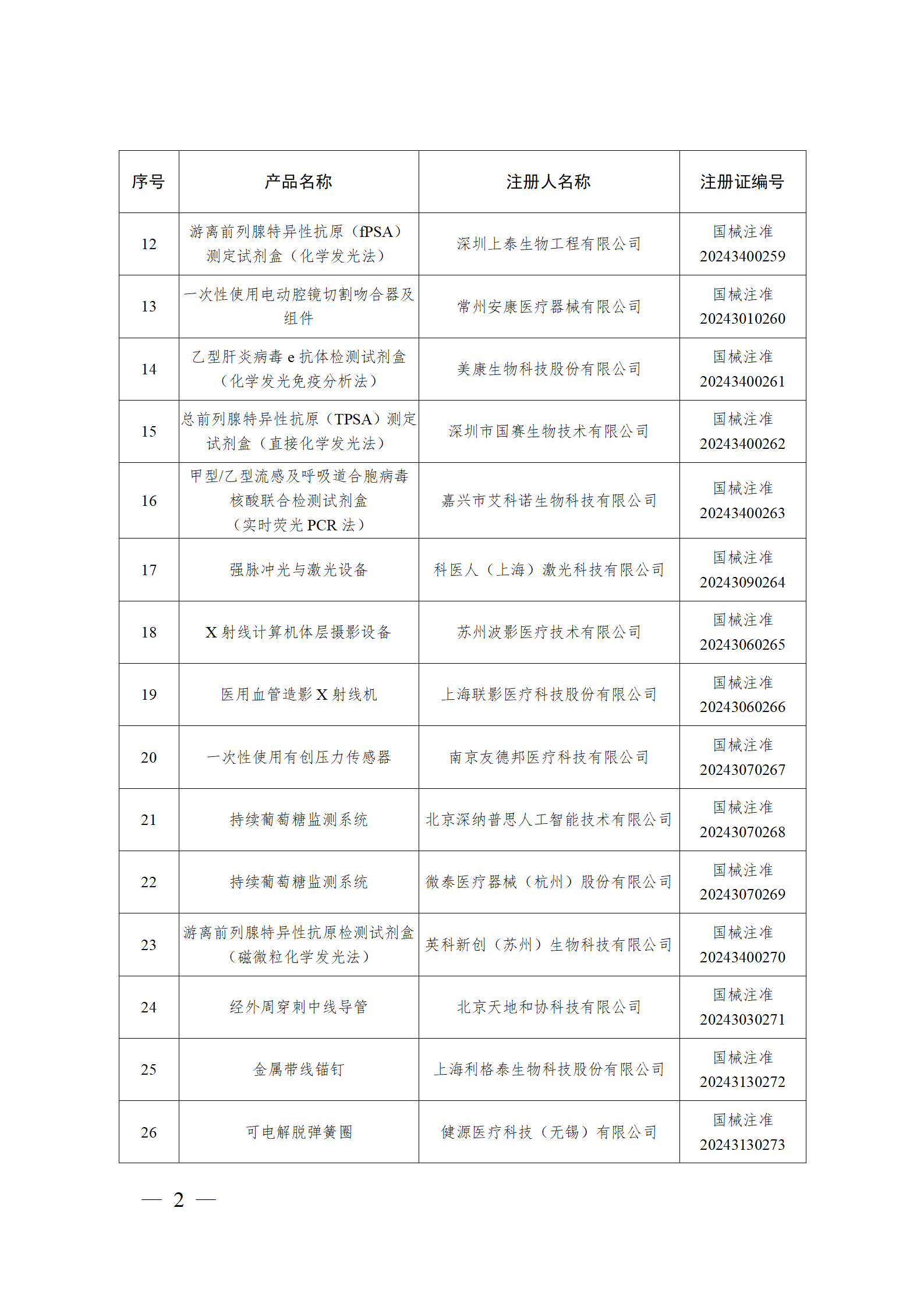
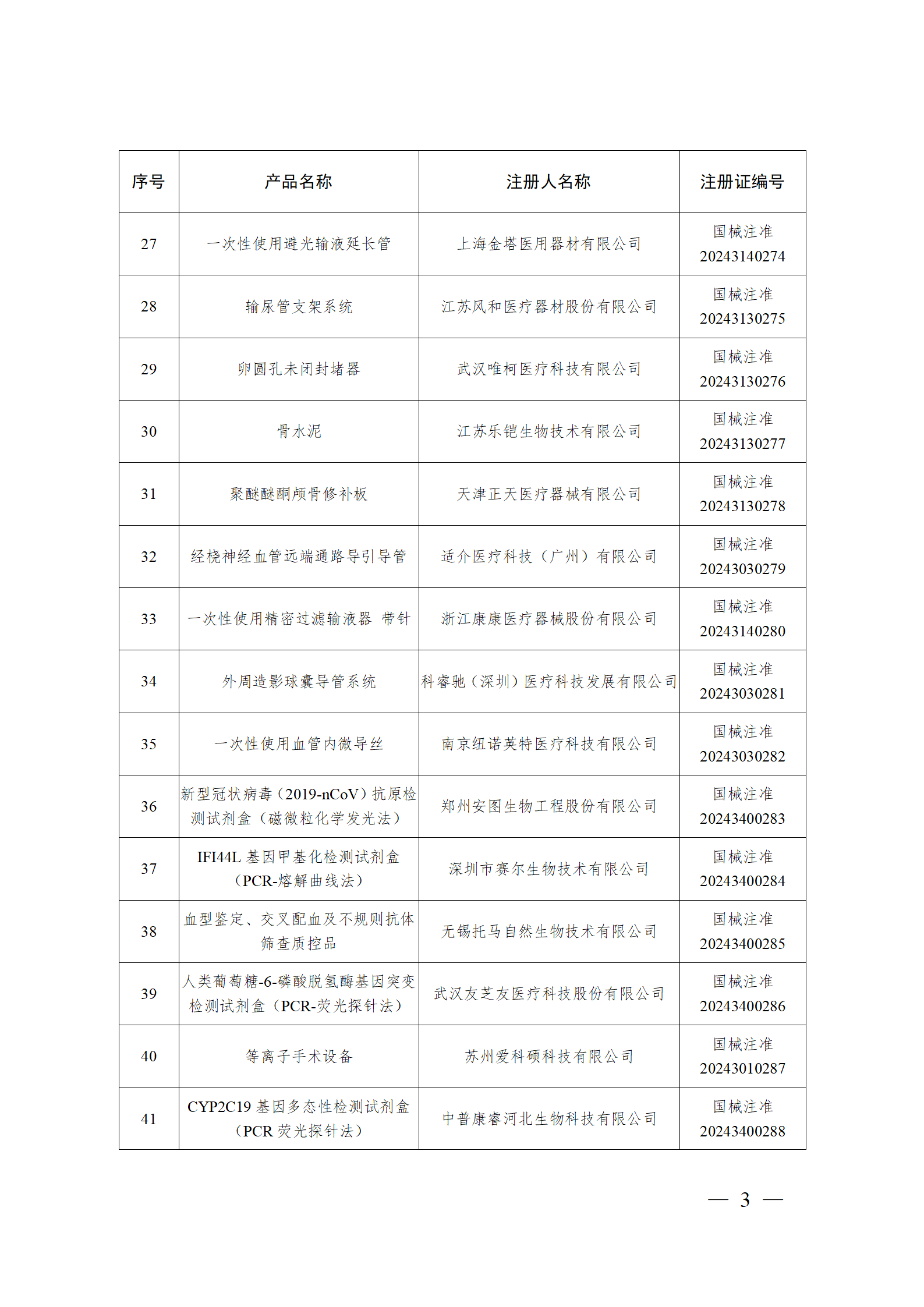
2024年2月,国家药监局共批准注册医疗器械产品193个。其中,境内第三类医疗器械产品148个,进口第三类医疗器械产品21个,进口第二类医疗器械产品22个,港澳台医疗器械产品2个(具体产品见图)。
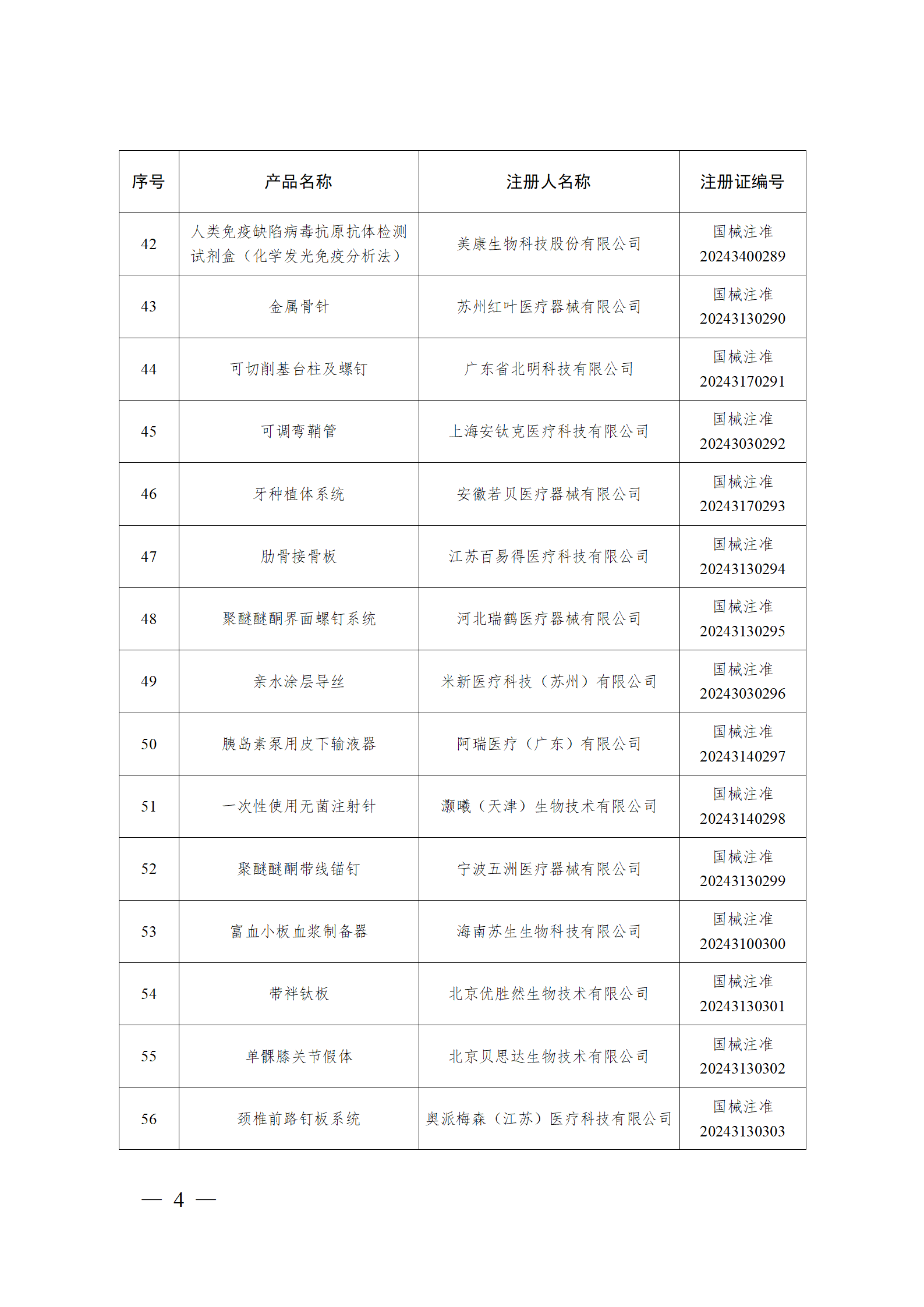
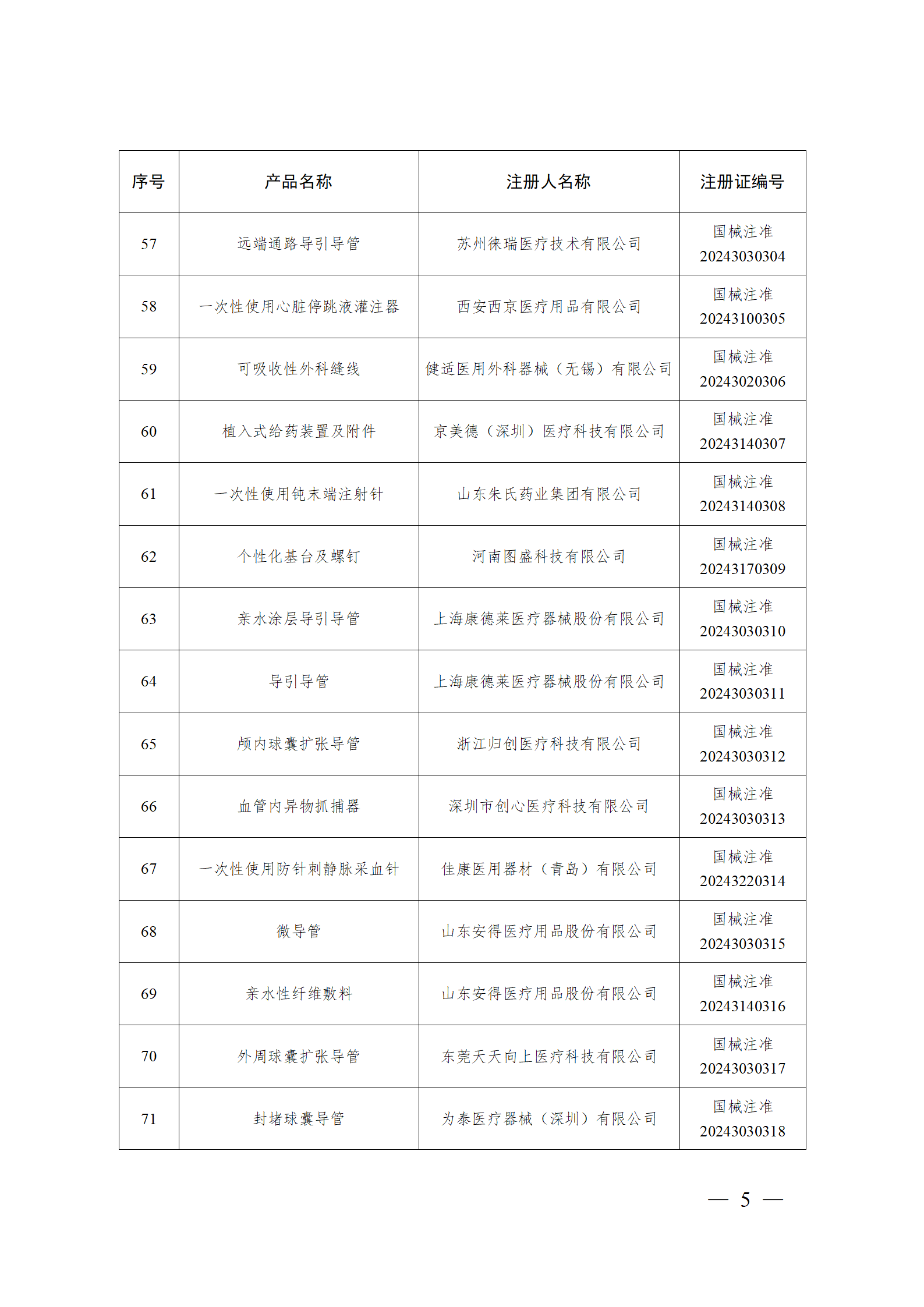
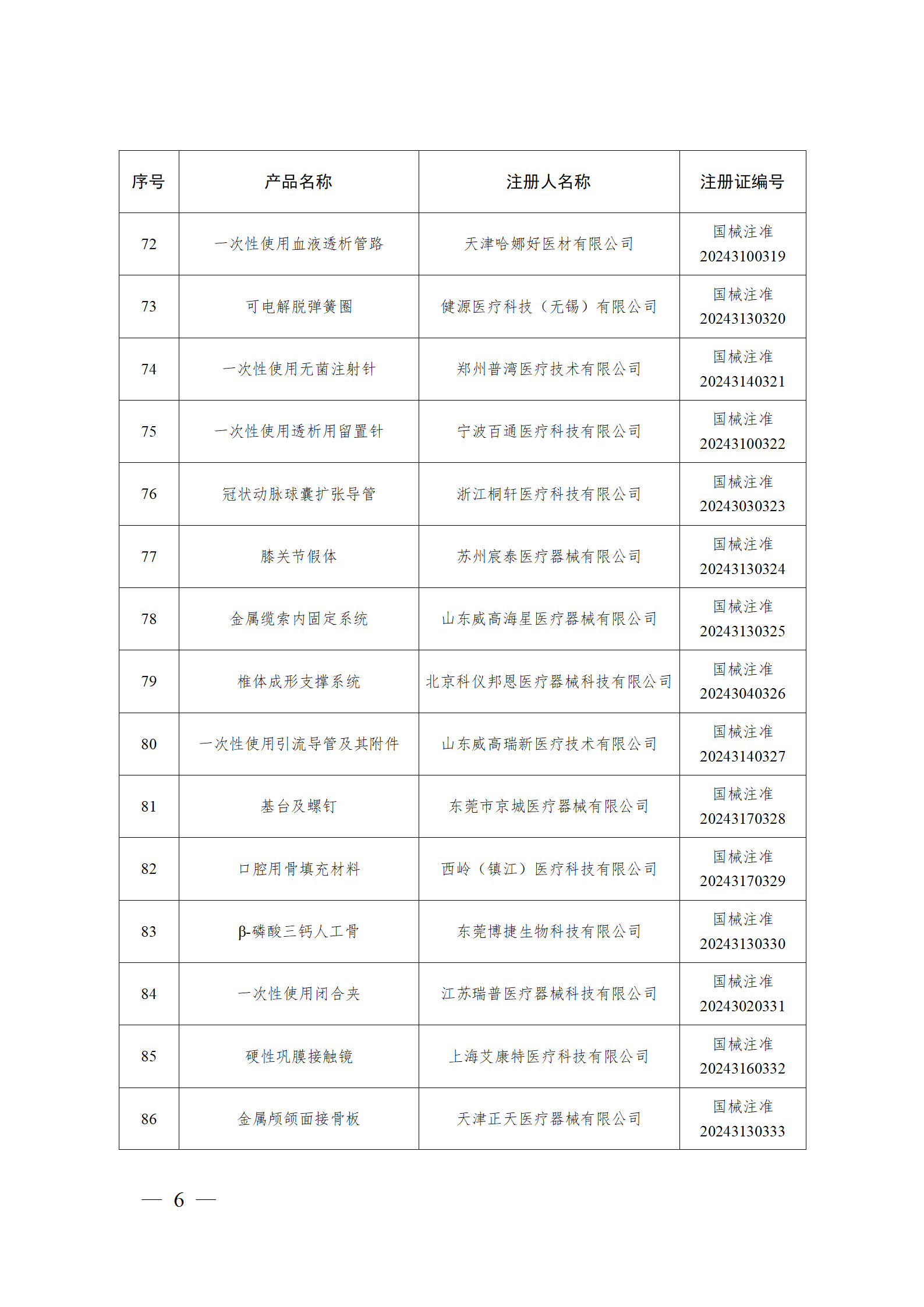
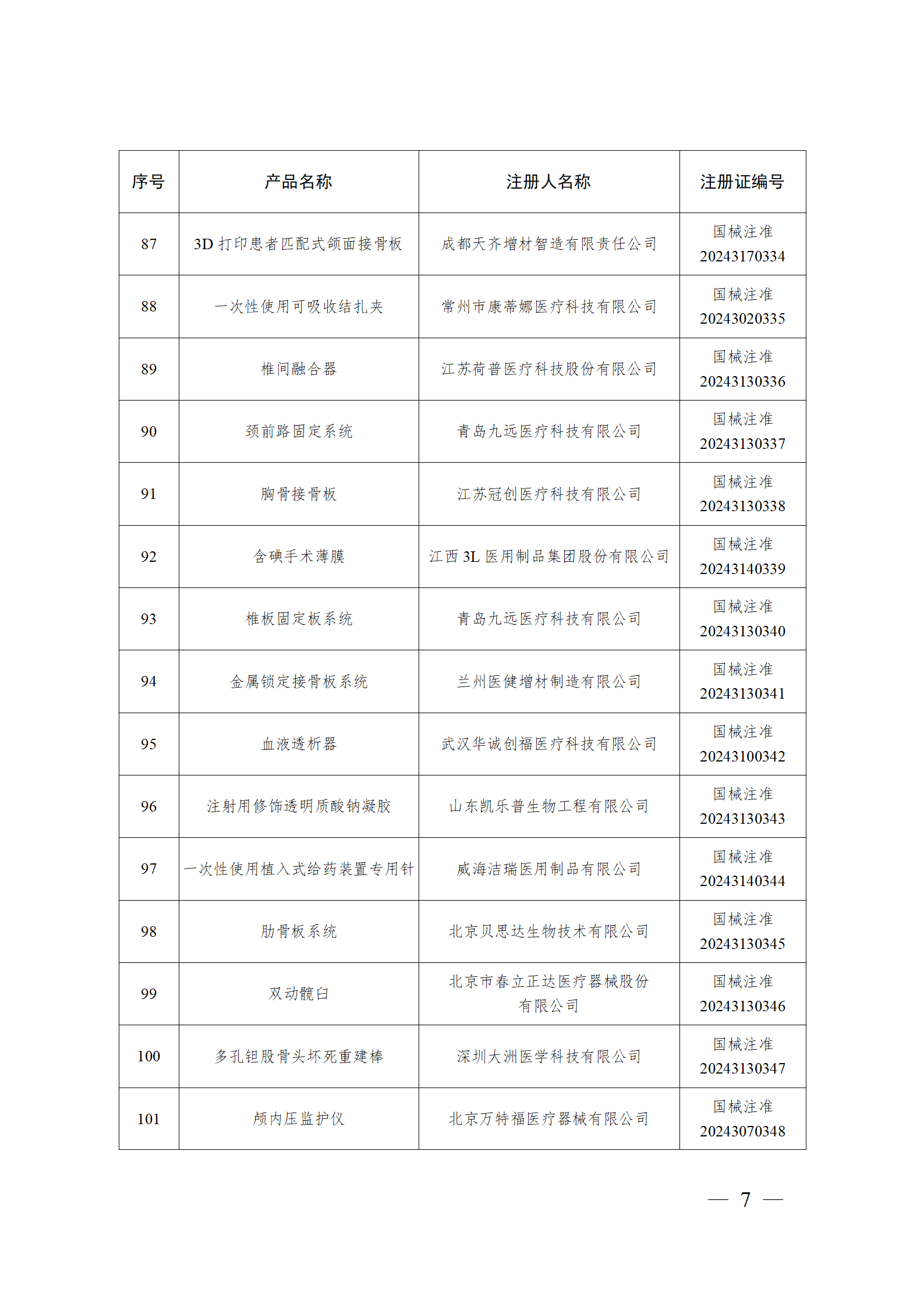
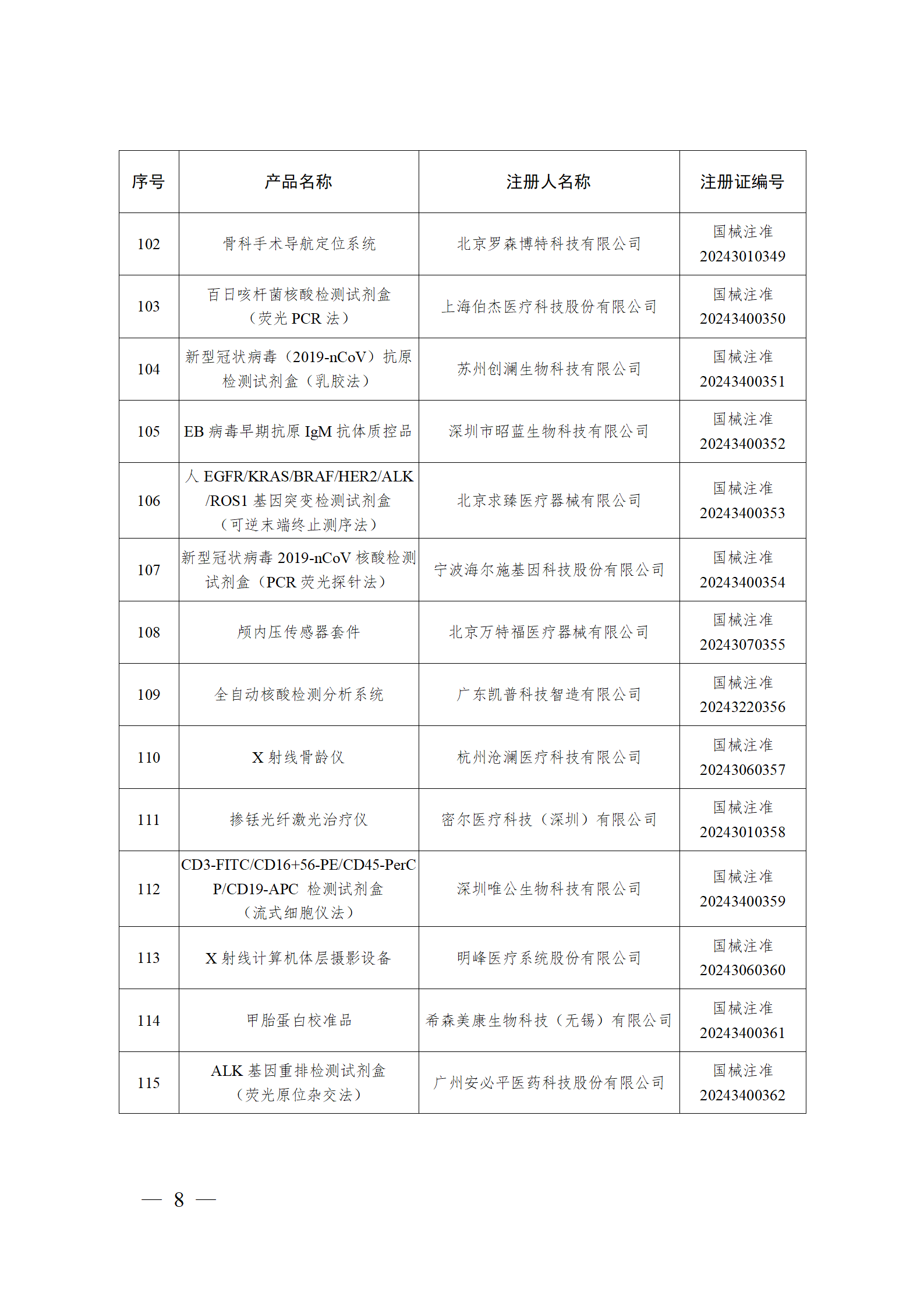
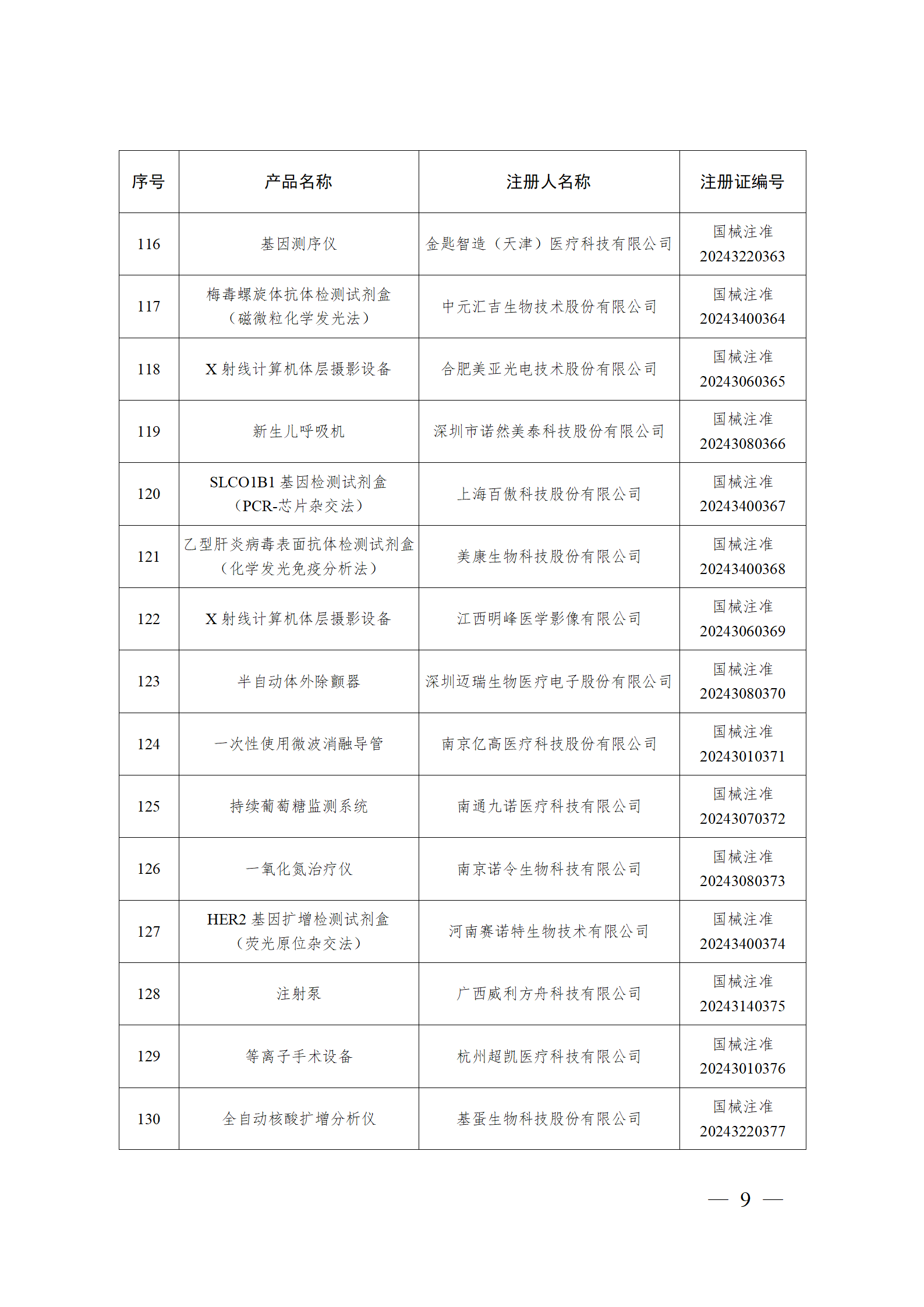
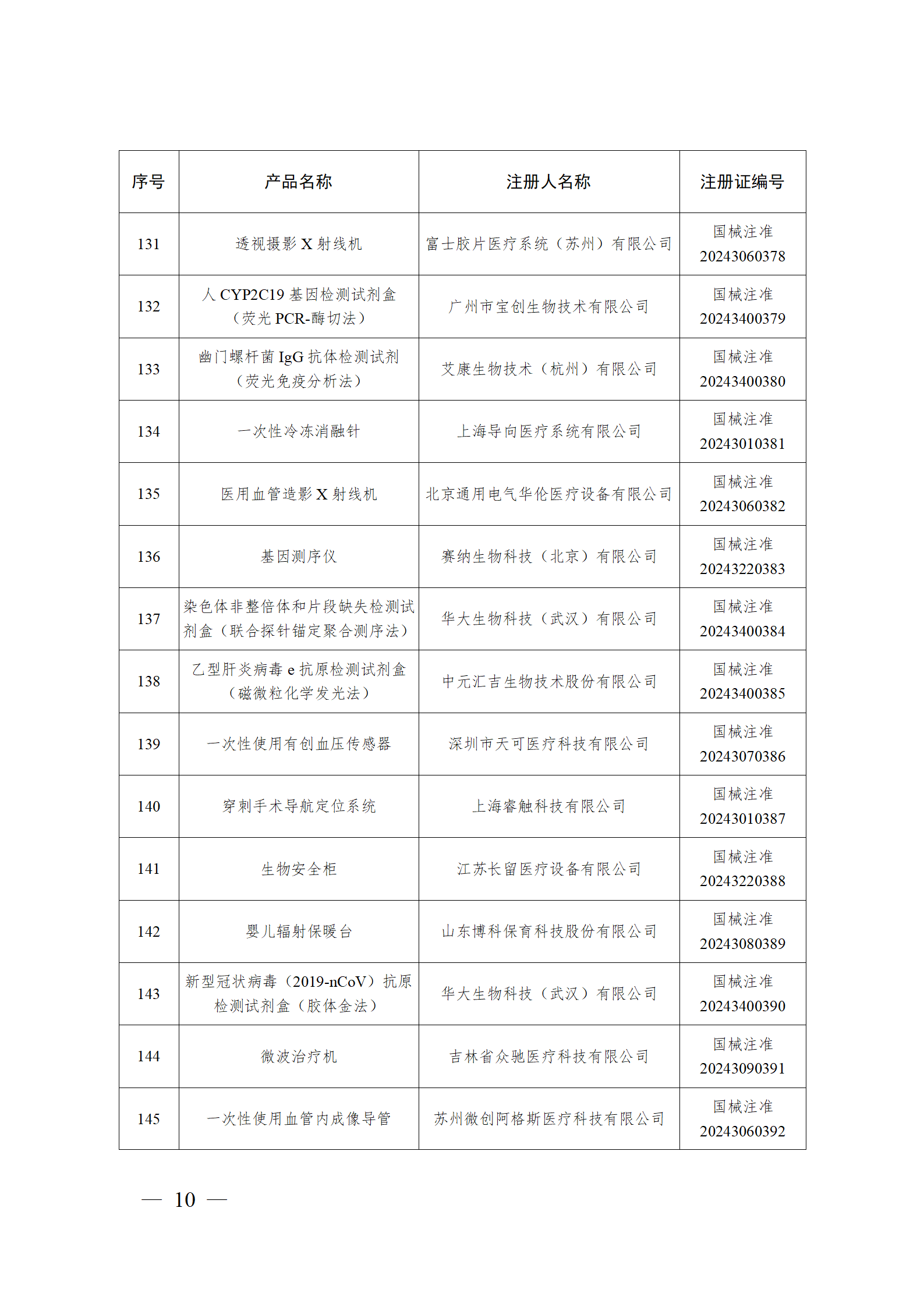
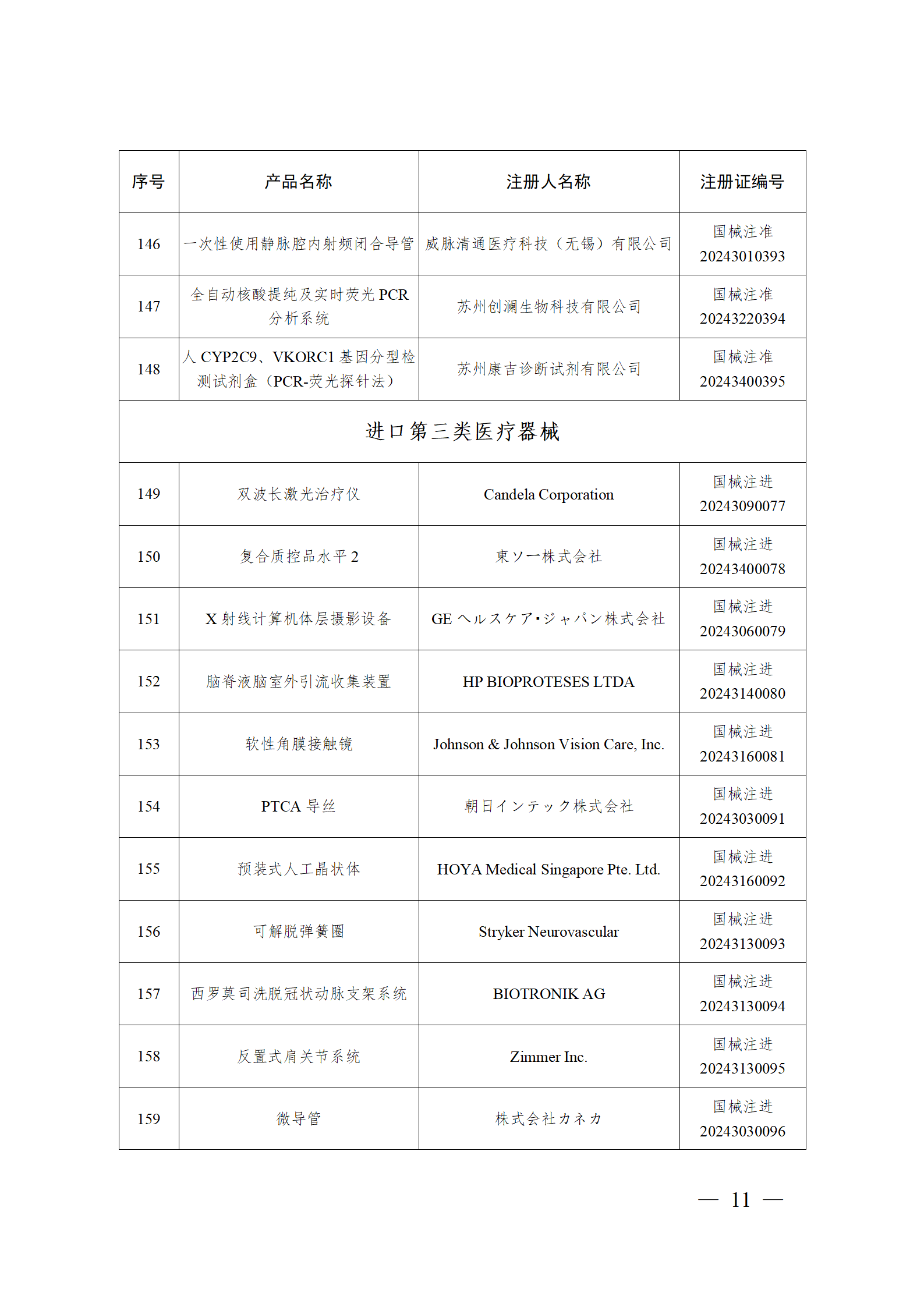
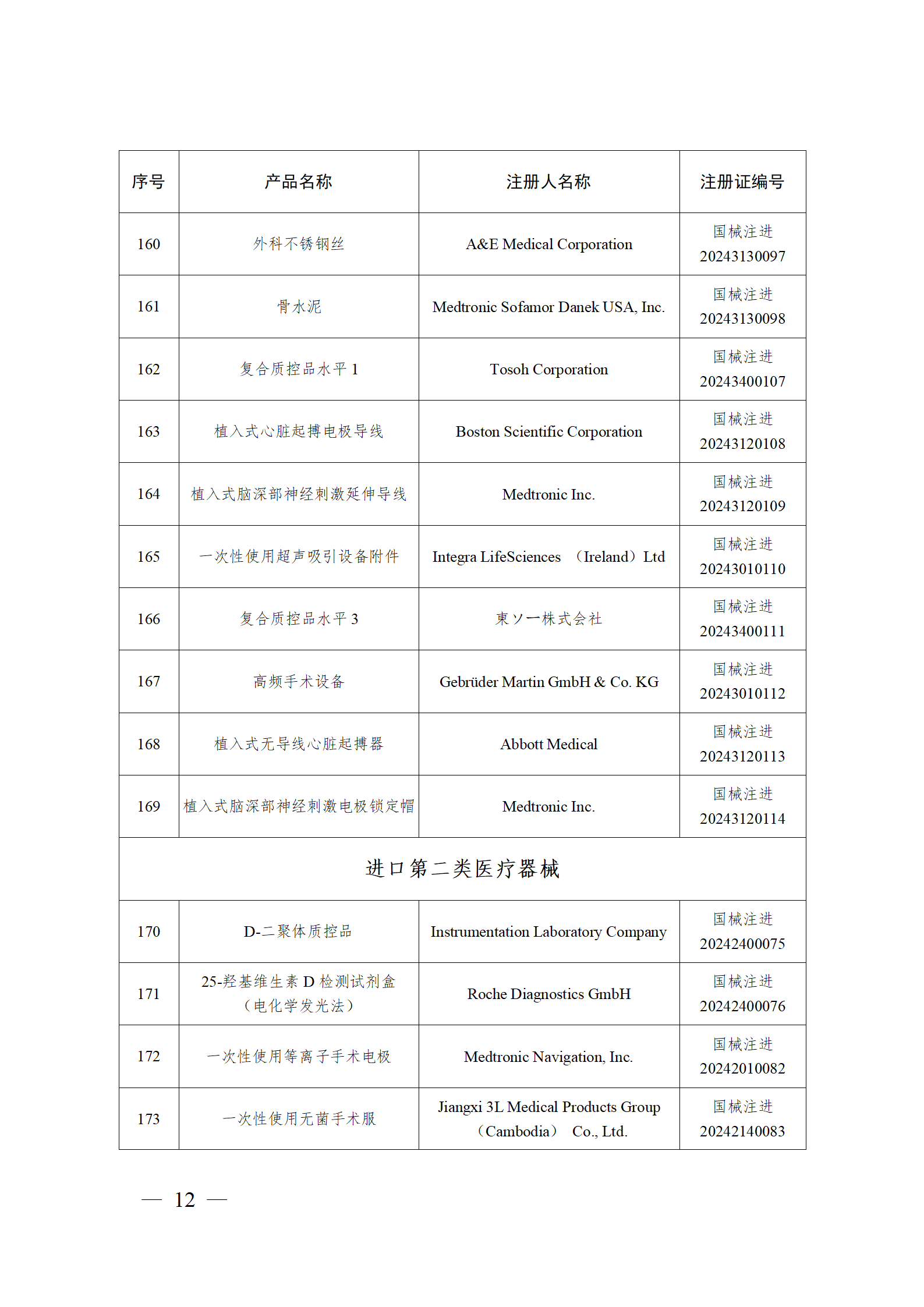
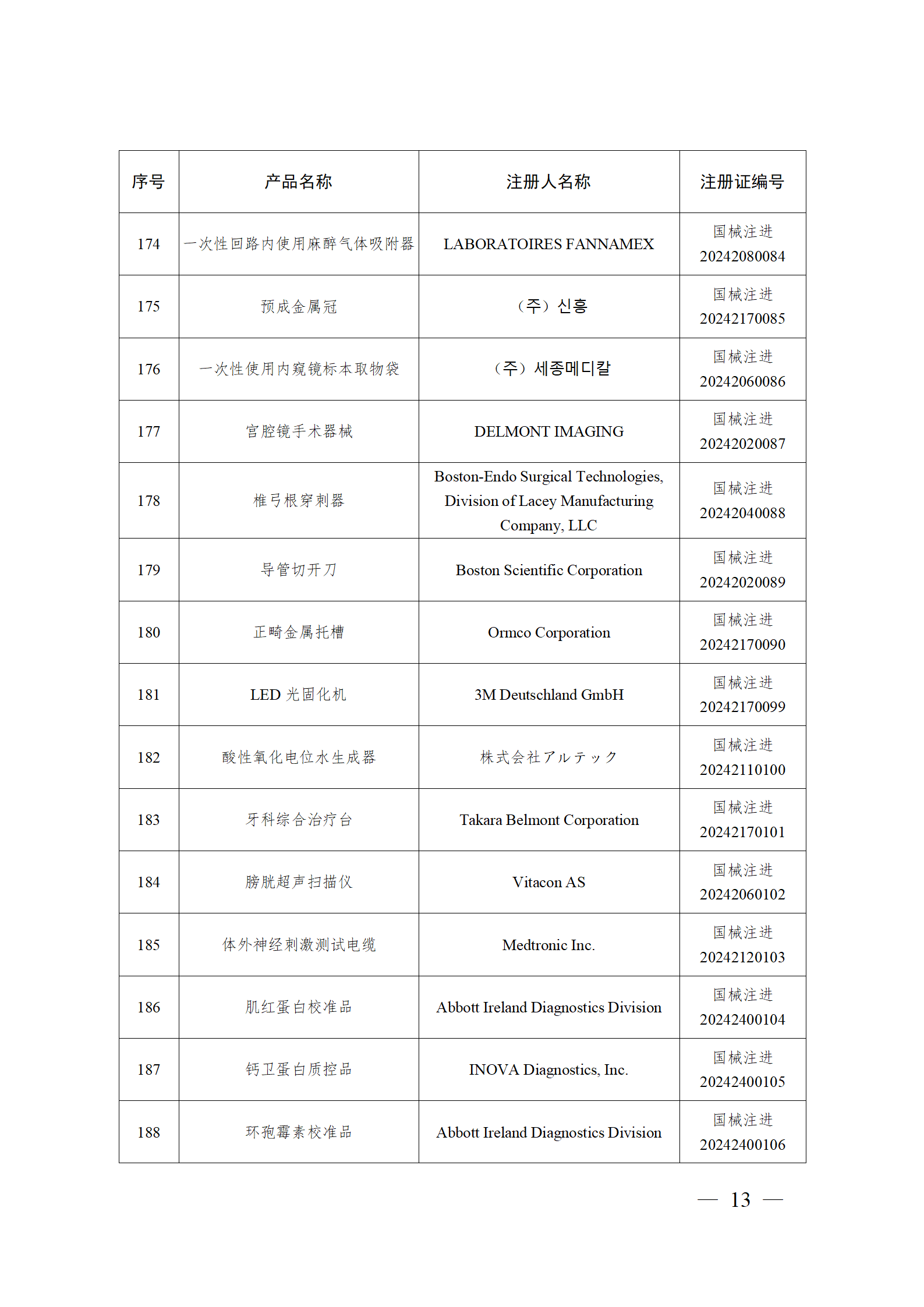
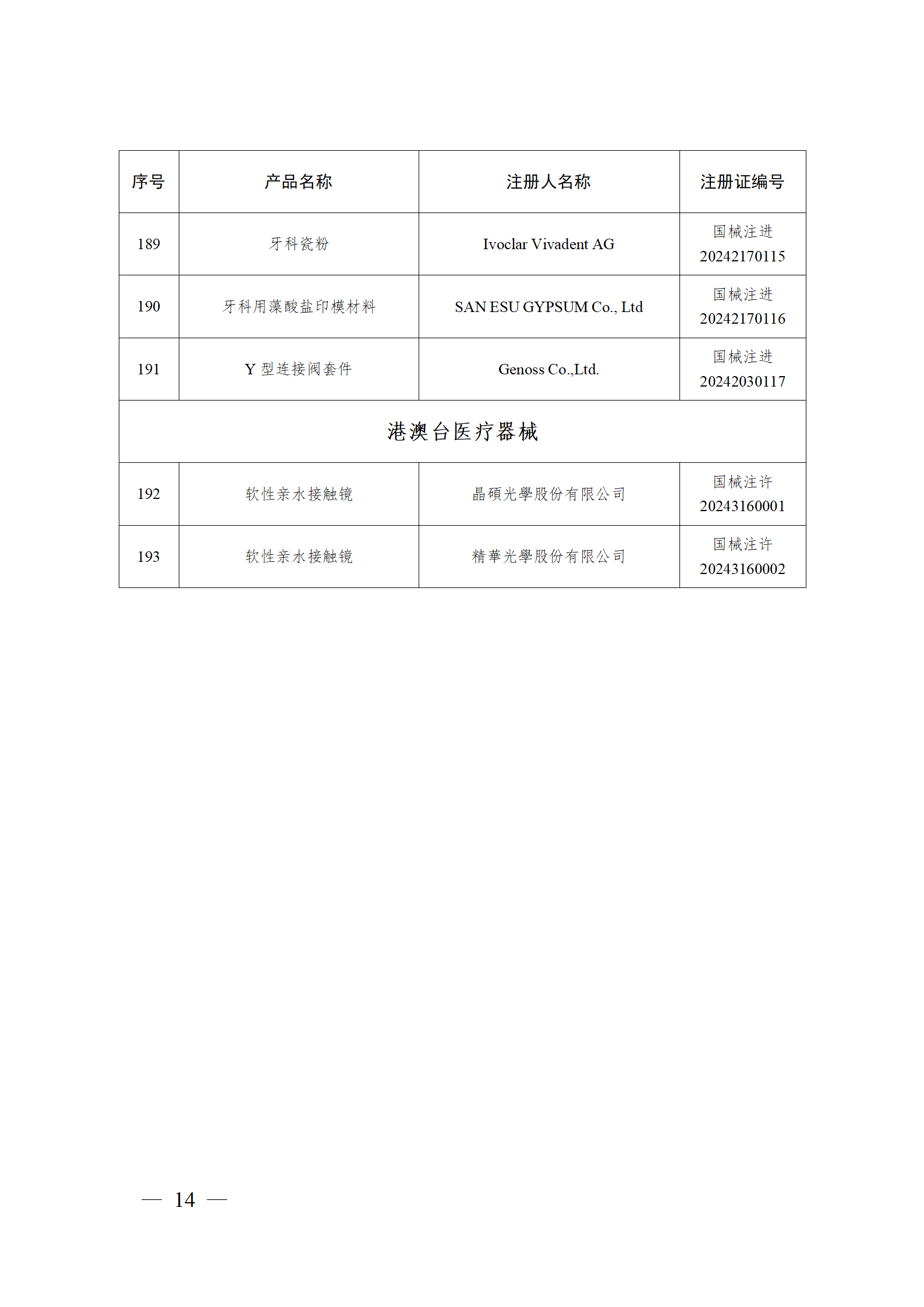
那么,医疗器械注册需要准备哪些资料?以二三类医疗器械来说:
第二类医疗器械注册申请材料
1.境内医疗器械注册申请表
2.资格证明
3.产品技术要求
4.安全风险分析报告
5.适用的产品标准及说明
6.产品性能自测报告
7.医疗器械检测机构出具的产品注册检测报告
8.医疗器械临床试验资料(如需)
9.医疗器械说明书
10.产品生产质量体系考核(认证)的有效证明文件
11.申请人应当对其所提交材料真实性的自我保证声明
12. 申请人不是法定代表人或负责人本人,企业应当提交《授权委托书》2份

第三类医疗器械注册申请材料
1.医疗器械注册申请表
2.医疗器械生产企业资格证明
3.产品技术报告(应加盖生产企业公章)
4.安全风险分析报告(应加盖生产企业公章)
5.适用的产品标准及说明
6.产品性能自测报告
7.医疗器械检测机构出具的产品注册检测报告
8.医疗器械临床试验资料
9.医疗器械说明书:
10.产品生产质量体系考核(认证)的有效证明文件
11.所提交材料真实性的自我保证声明
12.申请资料(重点是临床试验报告)和样品生产过程的真实性核查报告。

合华弈谨深耕医疗健康行业,助力企业更快更高效完成医疗器械生产/经营许可等业务办理需要,欢迎联系我们。